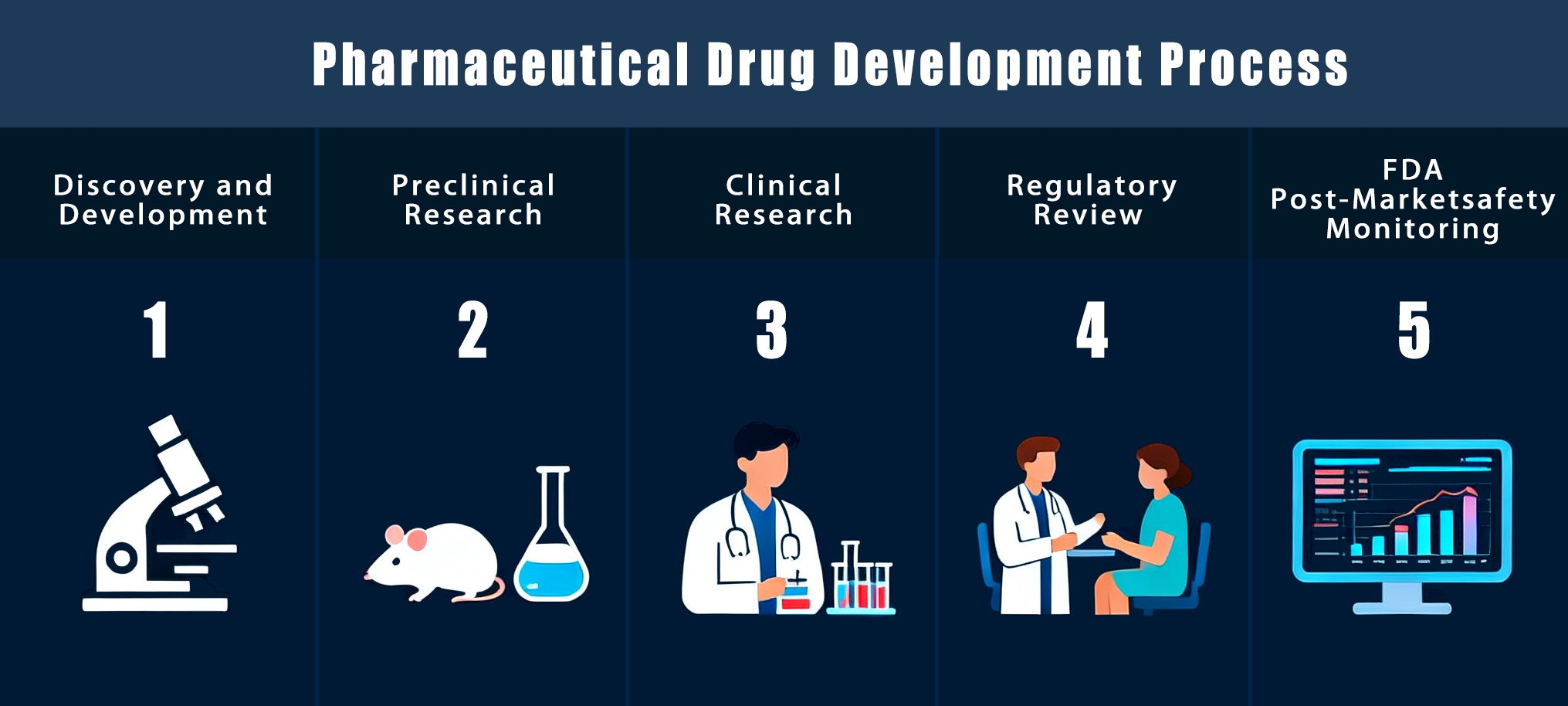
Die Entwicklung eines neuen Medikaments ist ein langer und sorgfältiger Prozess. Wissenschaftler erforschen Krankheiten, entwickeln Wirkstoffe, testen diese im Labor und führen Studien durch, um Sicherheit und Wirksamkeit zu überprüfen. Jeder Schritt ist wichtig, um Medikamente zu entwickeln, die Patienten helfen und ihre Gesundheit verbessern können. In diesem Artikel beschreiben wir den gesamten pharmazeutischen Entwicklungsprozess.

Erste Phase des Arzneimittelentwicklungsprozesses: Wirkstofffindung
Die Wirkstoffforschung ist der erste und wichtigste Schritt, bevor ein Medikament auf den Markt kommt. Pharmazeutische Produktionslinie. Dabei geht es darum, neue Wirkstoffe zu finden, ihre Wirkungsweise im Körper zu untersuchen und ihre Sicherheit in frühen Entwicklungsstadien zu testen. Diese Phase bildet die Grundlage für die Entwicklung sicherer und wirksamer Medikamente für Patienten.
Die Krankheit verstehen
Bevor ein neues Medikament entwickelt werden kann, müssen Wissenschaftler zunächst die Krankheit verstehen Sie wollen die Krankheit behandeln. Sie erforschen, wie sie entsteht, was sie verursacht und wie sie den Körper beeinflusst. Dies hilft ihnen, Schwachstellen zu finden, an denen ein Medikament am besten wirken kann.
Durch die Untersuchung verschiedener Patienten erkennen sie auch, wie sich die Krankheit von Person zu Person verändert. Dieser Schritt ist im pharmazeutischen Entwicklungsprozess von großer Bedeutung, da er die Gestaltung des Medikaments maßgeblich beeinflusst.
Identifizierung potenzieller Wirkstoffe
Nachdem die Krankheit erforscht wurde, suchen Wissenschaftler nach chemischen oder natürlichen Substanzen, die bei der Behandlung helfen könnten. Diese werden als potenzielle Wirkstoffe bezeichnet. Forscher testen Tausende von kleinen Molekülen und natürlichen Extrakten, um diejenigen zu identifizieren, die den Krankheitsverlauf blockieren oder verlangsamen können.
Beispielsweise testen sie eine pflanzliche Verbindung, die Infektionen bekämpft oder Entzündungen reduziert. Sobald einige vielversprechende Verbindungen identifiziert sind, werden diese weiter untersucht, um ihre Sicherheit und Wirksamkeit zu bewerten. Später können diese Verbindungen zu einem Arzneimittel weiterentwickelt werden. feste Darreichungsform, wie Tabletten oder Kapseln, die für Patienten sicher und einfach einzunehmen sind.
Den besten Kandidaten auswählen
Nachdem zahlreiche Substanzen getestet wurden, wählen Wissenschaftler diejenige aus, die die besten Ergebnisse liefert und für weitere Untersuchungen als sicher gilt. Die gewünschte Substanz sollte in Labortests gute Ergebnisse erzielen und die geringsten Nebenwirkungen verursachen.
Die Forscher untersuchen außerdem, wie sich die Substanz im Körper verhält, reagiert und abgebaut wird. Nur die vielversprechendste und stabilste Verbindung wird für weitere Studien ausgewählt. Diese Phase trägt dazu bei, dass Zeit und Aufwand in ein Medikament investiert werden, das die besten Erfolgsaussichten im pharmazeutischen Entwicklungsprozess hat.
Arzneimittelentwicklungsprozess
Sobald der geeignetste Wirkstoffkandidat ausgewählt ist, verlagert sich der Fokus von Entdeckungs- bis Entwicklungsstadien. Diese Phase umfasst die Prüfung der Arzneimittelsicherheit, die Untersuchung der Wirkung am Menschen, die Einholung der behördlichen Zulassung und die Vorbereitung auf die öffentliche Anwendung. Hier beginnt offiziell der pharmazeutische Entwicklungsprozess.
Präklinische Forschung und Prüfung
Bevor ein neues Medikament an Menschen getestet wird, durchläuft es präklinische Forschung und Tests. In dieser Phase untersuchen Wissenschaftler den Wirkstoff im Labor und an Tieren, um seine Wirkung im Körper zu beobachten.
Sie prüfen, wie es aufgenommen wird, wie lange es aktiv bleibt und ob es schädlich ist. präklinische Arzneimittelentwicklung Studien helfen dabei, die richtige Medikamentenmenge zu bestimmen, die im nächsten Schritt sicher verabreicht werden kann.
Bedeutung in der Pharmaindustrie
Diese Phase ist sehr wichtig in der Pharmaindustrie Denn dadurch lassen sich unsichere oder schwache Substanzen frühzeitig aussortieren, was Zeit und Kosten spart. Nur Medikamente, die sich als sicher und vielversprechend erweisen, gelangen in die klinische Prüfung am Menschen.
Die präklinische Forschung und Erprobung bilden eine solide Grundlage für den pharmazeutischen Arzneimittelentwicklungsprozess und gewährleisten, dass nur die sichersten und vielversprechendsten Arzneimittel für weitere Studien ausgewählt werden.
Klinische Studien und Humanstudien
Die nächste Phase im pharmazeutischen Entwicklungsprozess ist die Erprobung des Medikaments am Menschen. Nachdem präklinische Studien die Sicherheit des Medikaments belegen, geht es in die klinische Phase über. wichtige klinische Studien. Diese Versuche werden in mehreren Phasen durchgeführt, von denen jede ein bestimmtes Ziel verfolgt.
In der ersten Phase wird das Medikament einer kleinen Gruppe gesunder Personen verabreicht, um Sicherheit und Dosierung zu überprüfen. In den folgenden Phasen wird es an Patienten mit der betreffenden Krankheit getestet, um seine Wirksamkeit und mögliche Nebenwirkungen zu ermitteln.
Schrittweise Tests am Menschen
Jede Phase liefert den Forschern neue Erkenntnisse darüber, wie das Medikament im menschlichen Körper wirkt. Die letzte Phase umfasst eine große Anzahl von Patienten mit unterschiedlichem Hintergrund, um die Ergebnisse zu bestätigen und seltene Nebenwirkungen zu identifizieren.
Ärzte und Experten überwachen diese Studien sorgfältig, um die Sicherheit der Probanden zu gewährleisten. Klinische Studien und Untersuchungen am Menschen helfen zu entscheiden, ob ein Medikament für die öffentliche Anwendung geeignet ist oder noch verbessert werden muss.
Regulatorische Prüfung und Genehmigung
Nach erfolgreichen klinischen Studien am Menschen durchläuft das Medikament die Phase der behördlichen Prüfung und Zulassung. In dieser Phase wird geprüft, ob das neue Medikament alle Qualitäts- und Leistungsanforderungen erfüllt, bevor es auf den Markt gebracht werden darf.
Die Aufsichtsbehörden, darunter die FDA und die EMA, prüfen sorgfältig Berichte aus früheren Phasen des pharmazeutischen Arzneimittelentwicklungsprozesses, um sicherzustellen, dass das Arzneimittel sicher ist und wie erwartet wirkt.
Hauptschritte im Überprüfungsprozess
In dieser Phase müssen die Unternehmen Folgendes beachten:
- Reichen Sie vollständige Daten zu den Prüfverfahren, der Sicherheit und dem Herstellungsprozess des Arzneimittels ein.
- Zeigen Sie, dass die Produktion folgt ISO-Normen, die gute Qualitäts- und Sicherheitsstandards bestätigen.
- Bereitstellung von Kennzeichnungs-, Dosierungs- und Anwendungshinweisen für medizinisches Fachpersonal und Patienten.
Der Prüfprozess kann je nach Komplexität des Medikaments Monate oder sogar Jahre dauern. Erst wenn die Zulassungsbehörden zufrieden sind, erhält das Arzneimittel die endgültige Zulassung. Dieser Schritt schützt die Patienten und erhält das Vertrauen der Öffentlichkeit in die pharmazeutische Industrie, indem sichergestellt wird, dass jedes zugelassene Produkt globalen Qualitätsstandards entspricht.
Fertigung und Qualitätskontrolle
Nach der Zulassung eines Medikaments beginnt die Herstellungs- und Qualitätskontrollphase. In dieser Phase wird das Arzneimittel in großem Maßstab mit sauberen und streng kontrollierten Anlagen produziert. Jeder Schritt wird sorgfältig überwacht, um die Reinheit, Sicherheit und Stabilität des Produkts zu gewährleisten.
Viele Unternehmen nutzen Allgemeine Maschinenprodukte (GMP) zur Abwicklung von Abfüll-, Verpackungs- und Etikettierungsprozessen, die zur Aufrechterhaltung der Konsistenz in der pharmazeutischen Industrie beitragen.
Qualitätsprüfung in jeder Phase
Die Qualitätskontrolle wird während des gesamten Produktionsprozesses fortgesetzt. Experten testen Proben jeder Charge, um sicherzustellen, dass die Inhaltsstoffe und die Wirkung gleichbleibend sind. Auch die Verpackung wird geprüft, um das Medikament vor Licht, Luft und Feuchtigkeit zu schützen.
Maschinen und Werkzeuge werden regelmäßig gereinigt und geprüft, um Verunreinigungen zu vermeiden. Dieser Schritt trägt dazu bei, dass das Endprodukt sicher und von gleichbleibender Qualität bleibt, bevor es an Patienten ausgeliefert wird.
Sicherheitsüberwachung nach der Markteinführung
Auch nach der Zulassung und dem Verkauf eines neuen Medikaments geht die Arbeit weiter. Diese Phase wird als … bezeichnet. Überwachung nach der Markteinführung und Monitoring konzentriert sich darauf, zu beobachten, wie sich das Medikament verhält, sobald es von der Öffentlichkeit verwendet wird.
Selbst nach jahrelanger Forschung können manche Nebenwirkungen erst auftreten, wenn eine große Anzahl von Menschen das Medikament einnimmt. Diese Phase ist ein wichtiger Bestandteil der pharmazeutischen Arzneimittelentwicklung, da sie dazu beiträgt, die Patientensicherheit langfristig zu gewährleisten.
Kontinuierliche Beobachtung und Berichterstattung
Gesundheitsbehörden und Unternehmen sammeln Daten von Krankenhäusern, Apotheken und Patienten, um unerwünschte Nebenwirkungen zu erfassen. Ärzte und Apotheker sind angehalten, alle Auffälligkeiten zu melden. Werden schwerwiegende Probleme festgestellt, kann das Medikament zurückgerufen, aktualisiert oder mit neuen Warnhinweisen versehen werden. Die Unternehmen überprüfen außerdem die anhaltende Wirksamkeit des Medikaments.
Globale Herausforderungen in der Arzneimittelentwicklung
Der pharmazeutische Arzneimittelentwicklungsprozess steht vor vielen globalen Herausforderungen Dies erschwert es, dass neue Medikamente rechtzeitig zu den Patienten gelangen. Diese Herausforderungen verlangsamen den Fortschritt und beeinflussen, wie schnell lebensrettende Medikamente weltweit verfügbar werden.
Hohe Forschungs- und Produktionskosten
Die Entwicklung eines neuen Medikaments ist sehr kostspielig und langwierig. Unternehmen investieren hohe Summen in Labortests, Tierversuche und klinische Studien, bevor ein Medikament auf den Markt kommt. Kleine Unternehmen oder Forschungsgruppen haben oft Schwierigkeiten, sich diesen Prozess zu leisten, was Innovationen einschränkt.
Moderne Ausrüstung, Fachkräfte und spezielle Materialien treiben die Kosten zusätzlich in die Höhe. Da es mehr als ein Jahrzehnt dauern kann, bis ein neues Medikament auf den Markt kommt, verlieren die meisten Forscher im Laufe des Prozesses ihre Finanzierung. Deshalb werden nur wenige der frühen Entdeckungen jemals zu grundlegenden Medikamenten.
Strenge regulatorische Anforderungen
Jedes Land hat seine eigenen Regeln für die Zulassung neuer Arzneimittel. Diese Regeln sind wichtig für die Patientensicherheit, können den Prozess aber erheblich verlangsamen. Behörden wie die FDA in den USA oder die EMA in Europa prüfen sorgfältig jedes Detail der Herstellung und Prüfung eines Medikaments.
Wenn ein Unternehmen seine Medikamente in verschiedenen Ländern verkaufen möchte, muss es die jeweiligen gesetzlichen Bestimmungen jedes Landes erfüllen. Dies ist mit einem hohen Zeit- und Verwaltungsaufwand verbunden. Aus diesem Grund sind manche Medikamente in einem Land bereits erhältlich, während die Menschen in anderen Ländern noch auf die Zulassung warten.
Begrenzter Zugang zu Spitzentechnologie
Die moderne Arzneimittelforschung benötigt leistungsstarke Labore, qualifizierte Wissenschaftler, digitale Systeme und hochwertige Testgeräte, an denen es vielen Ländern noch immer mangelt. Manche Orte verfügen nicht über die notwendigen Voraussetzungen. Pharmazeutische Maschinen Um neue Wirkstoffe ordnungsgemäß zu testen, fehlt es manchen an qualifiziertem Personal, während andere mit einem Mangel an entsprechenden Hilfsmitteln zu kämpfen haben. Ohne diese Mittel wird es schwierig, neue Medikamente vor Ort zu entdecken oder herzustellen.
Viele Forscher müssen ihre Proben zur Testung ins Ausland schicken, was den Fortschritt verlangsamt und die Kosten erhöht. Zudem schränkt es die Möglichkeiten lokaler Wissenschaftler ein, neue Kompetenzen zu erwerben. Ein verbesserter Technologietransfer zwischen den Nationen könnte dazu beitragen, diese Kluft zu schließen und die Arzneimittelentwicklung weltweit gerechter zu gestalten.
Weltweit ungleicher Zugang zu Medikamenten
Viele Menschen erhalten auch nach der Zulassung eines Medikaments nicht die benötigten Arzneimittel. Hohe Preise und schwache Gesundheitssysteme führen dazu, dass Millionen unbehandelt bleiben. Wohlhabende Länder erhalten neue Medikamente meist zuerst. Ärmere Länder müssen jahrelang warten. Internationale Organisationen versuchen, diese Kluft zu verringern, doch sie bleibt ein großes Problem.
Manche Pharmaunternehmen konzentrieren sich eher auf Produkte mit höheren Gewinnmargen als auf solche, die dringende Bedürfnisse der öffentlichen Gesundheit befriedigen. Stärkere Partnerschaften zwischen Ländern können dazu beitragen, lebensrettende Behandlungen für alle zugänglich zu machen.
Ethische und sicherheitsrelevante Bedenken
Arzneimitteltests betreffen sowohl Menschen als auch Tiere und werfen daher viele ethische Fragen auf. Forscher müssen jeden Freiwilligen und jede Testperson mit Sorgfalt und Respekt behandeln. Allerdings gelten nicht in allen Ländern die gleichen Sicherheitsstandards, und manche ignorieren grundlegende Regeln, um Zeit oder Geld zu sparen. Dies kann zu Unfällen oder einer unfairen Behandlung der Teilnehmer führen.
Es bestehen auch Bedenken hinsichtlich der Medikamentenpreise. Menschen, die bei der Erprobung mitwirken, können sich die von ihnen mitentwickelten Medikamente später möglicherweise nicht mehr leisten. Ethische Verantwortung sollte in jeder Phase der Medikamentenentwicklung oberste Priorität haben, damit der Fortschritt niemals denjenigen schadet, denen er helfen soll.
Ethische und rechtliche Verantwortlichkeiten in der Arzneimittelentwicklung
Die Entwicklung pharmazeutischer Arzneimittel umfasst viele Phasen, in denen Ehrlichkeit und Sicherheit von höchster Bedeutung sind. Jedes Unternehmen und jeder Forscher ist verpflichtet, das menschliche Leben zu schützen und die Gesetze einzuhalten, die die Prüfung und Vermarktung von Arzneimitteln regeln.
Schutz der menschlichen Teilnehmer
Bei der Erprobung neuer Medikamente an Menschen hat der Schutz der Freiwilligen oberste Priorität. Sie müssen genau verstehen, worum es in der Studie geht, bevor sie ihre Teilnahme zusagen. Dies nennt man informierte Einwilligung. Niemand darf zur Teilnahme gezwungen oder getäuscht werden. Während klinischer Studien muss ihre Sicherheit an erster Stelle stehen, selbst wenn dies die Forschung verzögert oder die Kosten erhöht.
Datentransparenz und Ehrlichkeit
Alle Informationen aus Forschung und Tests müssen korrekt und vollständig sein. Negative Ergebnisse zu verschweigen oder Daten zu manipulieren, um ein Medikament als erfolgreich darzustellen, ist unethisch und illegal. Unternehmen müssen sowohl positive als auch negative Ergebnisse melden, damit zukünftige Ärzte und Patienten korrekte Informationen erhalten. Ehrliche Daten schaffen Vertrauen in der Öffentlichkeit und beugen Schaden vor.
Einhaltung gesetzlicher Bestimmungen
Regierungen legen strenge Regeln fest, um die Sicherheit, hohe Qualität und korrekte Kennzeichnung von Arzneimitteln zu gewährleisten. Internationale Gesetze wie die Gute Klinische Praxis (GCP) und die Gute Herstellungspraxis (GMP) definieren, wie Forschung und Produktion ablaufen müssen. Unternehmen, die gegen diese Regeln verstoßen, können ihre Zulassung verlieren oder mit rechtlichen Konsequenzen rechnen.
Faire Preise und Barrierefreiheit
Ethische Verantwortung endet nicht mit der Zulassung eines Medikaments. Viele neue Medikamente sind für arme Länder oder Menschen mit geringem Einkommen zu teuer. Unternehmen tragen eine soziale Verantwortung dafür, lebensrettende Medikamente für alle erschwinglich und zugänglich zu machen. Faire Preispolitik trägt dazu bei, Gewinn und Gemeinwohl in Einklang zu bringen.
Vermeidung von Tierquälerei
Tierversuche sind vor klinischen Studien am Menschen manchmal notwendig, sollten aber sorgfältig durchgeführt werden. Forscher sollten angehalten sein, so wenige Tiere wie möglich zu verwenden und tierschutzgerechte Praktiken anzuwenden. Moderne Alternativen wie Computermodelle oder Zellkulturen sollten bevorzugt werden.
FAQs
Was sind DS und DP in der Pharmabranche?
In der Pharmazie steht DS für Wirkstoff, also den aktiven Bestandteil eines Arzneimittels, der die gewünschte Wirkung erzielt. DP steht für Arzneimittel, also die fertige Darreichungsform des Arzneimittels, die Patienten anwenden, wie z. B. Tabletten, Kapseln oder Injektionen.
Was sind die fünf Regeln der Guten Herstellungspraxis (GMP)?
GMP (Good Manufacturing Practices) regelt die sichere und korrekte Herstellung von Arzneimitteln. Die fünf wichtigsten Regeln lauten: saubere und geeignete Anlagen nutzen; korrekte Herstellungsverfahren einhalten; alle Schritte genau dokumentieren; Mitarbeiter angemessen schulen; und die Produktqualität regelmäßig überprüfen.
Was sind NPI und NPD?
Die Produktentwicklung (NPD) umfasst die Erforschung, Entwicklung und Erprobung eines neuen Medikaments. Die Produkteinführung (NPI) ist der Prozess der Markteinführung eines neuen Medikaments, damit Patienten es anwenden können.
Abschluss
Die Entwicklung eines neuen Medikaments erfordert Zeit, Sorgfalt, fortschrittliche Technologie und moderne Ausrüstung, um in jedem Schritt Sicherheit zu gewährleisten. Hochwertige Maschinen spielen eine entscheidende Rolle dabei, Forschungsergebnisse in wirksame Medikamente umzusetzen. Wenn Sie pharmazeutische Maschinen für die Herstellung oder Verpackung suchen, Kontaktieren Sie uns noch heute. für angemessene Preise und pünktliche Lieferung.
Empfohlene Lektüre:
Was ist eine feste Arzneiformulierung? Eine einfache Anleitung für jedermann.
Wie werden Arzneimitteltabletten hergestellt? Eine einfache Anleitung zum Herstellungsprozess.
Was ist die Definition der Darreichungsform in der Pharmazie?