Разработка нового лекарства — долгий и кропотливый процесс. Учёные изучают заболевания, разрабатывают соединения, тестируют их в лаборатории и проводят испытания для проверки безопасности и эффективности. Каждый этап важен для создания лекарств, которые могут помочь пациентам и улучшить их здоровье. В этой статье мы рассмотрим весь процесс разработки фармацевтических препаратов.

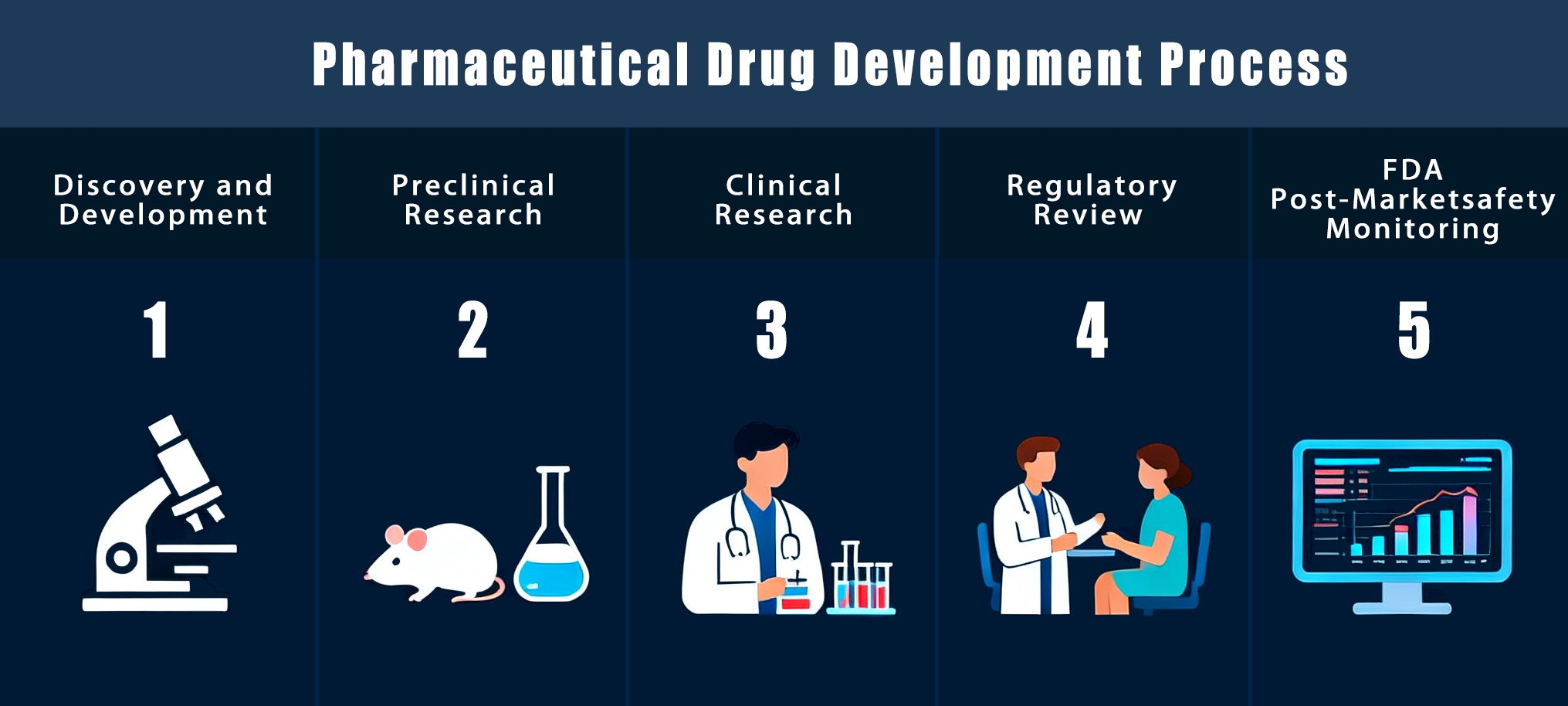
Первый этап процесса разработки лекарств: открытие новых лекарств
Открытие лекарств – это первый и самый важный шаг перед тем, как лекарство попадет в руки фармацевтическая производственная линия. Он включает в себя поиск новых соединений, изучение их действия в организме и проверку их безопасности на ранних стадиях. Этот этап закладывает основу для создания безопасных и полезных для пациентов лекарств.
Понимание болезни
Прежде чем создать новое лекарство, ученые должны сначала понять болезнь или заболевание Они хотят лечить. Они изучают, как болезнь начинается, что её вызывает и как она влияет на организм. Это помогает им найти слабые места, где лекарство может действовать лучше всего.
Изучая разных пациентов, они также видят, как заболевание меняется у разных людей. Этот этап очень важен в процессе разработки фармацевтических препаратов, поскольку он определяет их дизайн.
Поиск потенциальных лекарственных соединений
Изучив природу заболевания, учёные начинают поиск химических или природных веществ, которые могли бы помочь в его лечении. Они известны как потенциальные лекарственные компоненты. Исследователи тестируют тысячи малых молекул и натуральных экстрактов, чтобы найти те, которые могут блокировать или замедлить развитие болезни.
Например, они могут тестировать растительное соединение, которое борется с инфекцией или уменьшает воспаление. После того, как несколько перспективных соединений будут найдены, их изучают далее для оценки их безопасности и эффективности. Впоследствии эти соединения могут быть использованы для создания твердая лекарственная форма, такие как таблетки или капсулы, которые безопасны и удобны для приема пациентами.
Выбор лучшего кандидата
После тестирования множества соединений учёные выбирают то, которое показывает наилучшие результаты и безопасно для дальнейшего изучения. Желаемое соединение должно хорошо себя зарекомендовать в лабораторных испытаниях и вызывать наименьшие побочные эффекты.
Исследователи также проверяют, как вещество движется, реагирует и распадается в организме. Для дальнейшего изучения отбирается только наиболее перспективное и стабильное соединение. Этот этап помогает убедиться, что время и усилия направлены на препарат, имеющий наилучшие шансы на успех в процессе разработки фармацевтического препарата.
Процесс разработки фармацевтических препаратов
После того, как выбран наиболее подходящий кандидат на лекарство, фокус смещается с от открытия до стадии разработки. Этот этап включает в себя проверку безопасности препарата, изучение его воздействия на людей, получение разрешения регулирующих органов и подготовку к публичному применению. Именно здесь официально начинается процесс разработки фармацевтического препарата.
Доклинические исследования и испытания
Прежде чем новый препарат будет испытан на людях, он проходит доклинические исследования и испытания. На этом этапе учёные изучают препарат в лабораториях и на животных, чтобы понять, как он действует в организме.
Они проверяют, как он усваивается, как долго сохраняет активность и не наносит ли он вреда. доклиническая разработка лекарств исследования помогают определить правильную дозу препарата, которую можно безопасно назначить на следующем этапе.
Значение в фармацевтической отрасли
Этот этап очень важен в фармацевтическая промышленность Поскольку это помогает на ранних стадиях исключить небезопасные или слабые соединения, экономя время и деньги. Только препараты, показавшие безопасные и надёжные результаты, допускаются к испытаниям на людях.
Доклинические исследования и испытания формируют прочную основу для процесса разработки фармацевтических препаратов, гарантируя, что для дальнейших испытаний будут отобраны только самые безопасные и перспективные лекарственные средства.
Клинические испытания и исследования на людях
Следующий этап разработки фармацевтического препарата — тестирование на людях. После того, как доклинические исследования подтверждают безопасность препарата, он переходит в стадию важные клинические испытания. Эти испытания проводятся в несколько этапов, каждый из которых имеет определенную цель.
На первом этапе препарат дают небольшой группе здоровых людей для проверки безопасности и дозировки. На последующих этапах его испытывают на пациентах с данным заболеванием, чтобы оценить эффективность препарата и наличие побочных эффектов.
Пошаговое тестирование на людях
Каждая фаза даёт исследователям больше знаний о действии препарата на реальных людях. Заключительная фаза включает в себя исследование большого количества пациентов из разных слоев общества для подтверждения результатов и выявления редких побочных эффектов.
Врачи и эксперты внимательно следят за этими исследованиями, чтобы обеспечить безопасность добровольцев. Клинические испытания и исследования на людях помогают решить, готов ли препарат к широкому применению или нуждается в доработке.
Нормативный обзор и одобрение
После успешного тестирования на людях препарат проходит этап рассмотрения и одобрения регулирующими органами. На этом этапе проверяется соответствие нового препарата всем требованиям к качеству и эффективности, прежде чем он поступит в продажу.
Регулирующие органы, включая FDA и EMA, тщательно изучают отчеты ранних стадий процесса разработки фармацевтических препаратов, чтобы убедиться, что лекарство безопасно и действует так, как ожидается.
Основные этапы процесса проверки
На этом этапе компании должны:
- Предоставьте полные данные по испытаниям, безопасности и процессу производства препарата.
- Покажите, что производство следует стандарты ИСО, которые подтверждают высокое качество и безопасность.
- Предоставьте медицинским работникам и пациентам информацию о маркировке, дозировке и применении.
Процесс проверки может занять месяцы или даже годы, в зависимости от сложности препарата. Только после того, как регулирующие органы дадут положительное заключение, лекарство получает окончательное одобрение. Этот этап защищает пациентов и поддерживает общественное доверие к фармацевтической отрасли, гарантируя соответствие каждого одобренного продукта международным стандартам качества.
Производство и контроль качества
После одобрения лекарственного препарата он переходит на этап производства и контроля качества. На этом этапе лекарственное средство производится в больших масштабах на чистом и хорошо контролируемом оборудовании. Каждый этап тщательно контролируется, чтобы гарантировать чистоту, безопасность и стабильность продукта.
Многие компании используют Продукция общего машиностроения (GMP) для управления процессами наполнения, упаковки и маркировки, которые помогают поддерживать единообразие в фармацевтической отрасли.
Проверка качества на каждом этапе
Контроль качества осуществляется на протяжении всего процесса производства. Эксперты проверяют образцы из каждой партии, чтобы убедиться в стабильности состава и результатов. Упаковка также проверяется на предмет защиты препарата от света, воздуха и влаги.
Оборудование и инструменты регулярно очищаются и проверяются во избежание заражения. Этот этап помогает гарантировать безопасность и неизменное качество конечного продукта перед его отправкой пациентам.
Мониторинг безопасности после продажи
После одобрения и продажи нового лекарства работа не останавливается. Этот этап, называемый пострыночный надзор и мониторинг, направленный на наблюдение за тем, как препарат действует после его использования населением.
Даже после многих лет исследований некоторые побочные эффекты могут проявляться только при приёме препарата большим количеством людей. Этот этап — важная часть процесса разработки фармацевтического препарата, поскольку он помогает обеспечить безопасность пациентов в долгосрочной перспективе.
Непрерывное наблюдение и отчетность
Органы здравоохранения и компании собирают данные из больниц, аптек и пациентов для отслеживания любых нежелательных реакций. Врачей и фармацевтов просят сообщать обо всех замеченных ими необычных реакциях. При обнаружении серьёзных проблем препарат может быть отозван, обновлен или выданы новые предупреждения. Компании также проверяют эффективность препарата.
Глобальные проблемы в разработке лекарств
Процесс разработки фармацевтических препаратов сталкивается со многими глобальными проблемами Это затрудняет своевременное получение новых лекарств пациентами. Эти проблемы замедляют прогресс и влияют на скорость, с которой жизненно важные препараты становятся доступны людям по всему миру.
Высокие затраты на исследования и производство
Разработка нового лекарства — очень дорогостоящее занятие, которое занимает много лет. Компании тратят огромные средства на лабораторные исследования, исследования на животных и клинические испытания, прежде чем препарат попадёт на рынок. Небольшим компаниям и исследовательским группам сложно оплатить этот процесс, что ограничивает инновации.
Современное оборудование, опытные специалисты и специальные материалы также увеличивают расходы. Поскольку вывод нового препарата на рынок может занять более десяти лет, большинство исследователей теряют финансирование в процессе разработки. Именно поэтому лишь немногие из ранних открытий становятся фундаментальными лекарствами.
Строгие нормативные требования
В каждой стране свои правила регистрации новых лекарств. Эти правила важны для обеспечения безопасности пациентов, но могут значительно замедлить процесс. Такие агентства, как FDA в Америке или EMA в Европе, тщательно проверяют каждую деталь производства и тестирования препарата.
Когда компания хочет продавать свои лекарства в разных странах, ей необходимо соблюдать действующие в каждой из них правовые нормы. Это требует много времени и бумажной волокиты. Из-за этого некоторые препараты поступают на рынок в одной стране, а в других странах им всё ещё приходится ждать одобрения.
Ограниченный доступ к передовым технологиям
Современные исследования лекарственных препаратов требуют мощных лабораторий, квалифицированных учёных, цифровых систем и качественного испытательного оборудования, которого во многих странах всё ещё не хватает. В некоторых местах нет необходимого оборудования. фармацевтическое оборудование Для надлежащего тестирования новых препаратов, в то время как другие сталкиваются с нехваткой квалифицированного персонала. Без этих инструментов становится сложно разрабатывать и производить новые лекарства на местном уровне.
Многим исследователям приходится отправлять свои образцы для испытаний за границу, что замедляет прогресс и увеличивает расходы. Это также ограничивает возможности местных учёных приобретать новые навыки. Более эффективный обмен технологиями между странами может помочь сократить этот разрыв и сделать разработку лекарств более сбалансированной во всём мире.
Неравный доступ к лекарствам во всем мире
Многие люди по-прежнему не могут получить необходимые лекарства, даже после того, как препарат одобрен. Высокие цены и слабые системы здравоохранения оставляют миллионы людей без лечения. Богатые страны обычно получают новые лекарства первыми. Более бедные ждут годами. Международные организации пытаются сократить этот разрыв, но он по-прежнему остаётся серьёзной проблемой.
Некоторые фармацевтические компании также больше внимания уделяют продуктам, приносящим большую прибыль, а не тем, которые отвечают неотложным потребностям общественного здравоохранения. Более тесное партнерство между странами может помочь сделать жизненно важные методы лечения доступными для всех.
Вопросы этики и безопасности
Испытания на наркотики проводятся как на людях, так и на животных, что поднимает множество этических вопросов. Исследователи должны относиться к каждому добровольцу и подопытному с заботой и уважением. Однако не во всех странах соблюдаются одинаковые стандарты безопасности, а некоторые могут игнорировать основные правила, чтобы сэкономить время или деньги. Это может привести к несчастным случаям или несправедливому отношению к участникам.
Существуют также опасения по поводу ценообразования лекарств. Люди, участвующие в испытаниях, могут впоследствии оказаться не в состоянии позволить себе лекарство, которое они помогли создать. Этическая ответственность должна быть важнейшим аспектом на каждом этапе разработки лекарств, чтобы прогресс никогда не наносил вред тем, кому он призван помочь.
Этическая и правовая ответственность при разработке лекарственных препаратов
Процесс разработки фармацевтических препаратов включает множество этапов, где честность и безопасность играют важнейшую роль. Каждая компания и исследователь обязаны защищать человеческую жизнь и соблюдать законы, регулирующие испытания и маркетинг лекарственных средств.
Защита участников-людей
При испытании новых препаратов на людях первым правилом является защита добровольцев. Прежде чем согласиться на участие, они должны чётко понимать суть исследования. Это называется информированным согласием. Никого нельзя принуждать или обманным путём склонять к участию. Во время клинических испытаний безопасность добровольцев должна быть на первом месте, даже если это задерживает исследования или увеличивает расходы.
Прозрачность и честность данных
Вся информация, полученная в ходе исследований и испытаний, должна быть точной и полной. Сокрытие отрицательных результатов или изменение данных для создания видимости успешного препарата неэтично и незаконно. Компании обязаны сообщать как о положительных, так и о отрицательных результатах, чтобы врачи и пациенты в будущем получали правильную информацию. Честные данные укрепляют общественное доверие и предотвращают вред.
Следуя правовым нормам
Правительства устанавливают строгие правила, гарантирующие безопасность, высокое качество и надлежащую маркировку лекарственных средств. Международные законы, такие как «Надлежащая клиническая практика» и «Надлежащая производственная практика», определяют, как должны проводиться исследования и производство. Компании, нарушающие эти правила, могут лишиться лицензий или быть привлечены к ответственности.
Справедливые цены и доступность
Этика не прекращается после одобрения препарата. Многие новые препараты слишком дороги для бедных стран или людей с низким доходом. Компании несут социальную ответственность за обеспечение доступности жизненно важных лекарств для всех. Справедливая ценовая политика поможет сбалансировать прибыль и общественное благо.
Избежание жестокого обращения с животными
Иногда перед испытаниями на людях необходимо проводить испытания на животных, но их следует проводить с осторожностью. Исследователи должны использовать минимально возможное количество животных и соблюдать гуманные методы. При наличии современных альтернатив, таких как компьютерные модели или клеточные культуры, предпочтение следует отдавать именно им.
Часто задаваемые вопросы
Что такое DS и DP в фармацевтике?
В фармацевтике DS означает «Drug Substance» (лекарственное вещество) — активный ингредиент лекарства, оказывающий желаемый эффект. DP означает «Drug Product» (лекарственный продукт) — готовая форма лекарства, используемая пациентами, например, таблетки, капсулы или инъекции.
Каковы пять правил GMP?
GMP (надлежащая производственная практика) регламентирует безопасное и правильное производство лекарственных средств. Пять основных правил: использование чистых, надлежащих помещений; соблюдение правил производства; ведение точного учета всех этапов; надлежащее обучение персонала; регулярная проверка качества продукции.
Что такое НПИ и НПД?
Разработка нового продукта (NPD) — это процесс исследования, проектирования и тестирования нового лекарственного средства. Введение нового продукта (NPI) — это процесс вывода нового лекарственного средства на рынок для предоставления его пациентам.
Заключение
Разработка нового лекарства требует времени, тщательности, передовых технологий и современного оборудования, обеспечивающего безопасность на каждом этапе. Высококачественное оборудование играет важную роль в превращении результатов исследований в лекарства, которые помогают людям. Если вы ищете фармацевтическое оборудование для производства или упаковки, свяжитесь с нами сегодня за разумные цены и своевременную доставку.
Рекомендуемая литература:
Что такое твердая лекарственная форма? Простое руководство для всех.
Как производятся лекарственные таблетки? Простое руководство по производственному процессу.