İlaç şirketlerinin en büyük baskıyı hissettiği aşama genellikle Yeni İlaç Başvurusu (NDA) aşamasıdır. Bu aşamada, yıllarca süren geliştirme, test ve yatırımlar FDA tarafından resmen incelenir.
Basitçe ifade etmek gerekirse, ilaç sektöründe NDA (Yeni İlaç Başvurusu), bir şirketin yeni bir ilaç için onay talebinde bulunmak üzere FDA'ya (ABD Gıda ve İlaç İdaresi) sunduğu belgedir. Bu, herhangi bir ilaç geliştirme sürecinde önemli bir dönüm noktasıdır.
Dolayısıyla, yeni bir formülasyon geliştiriyorsanız veya üretimi ölçeklendirmeye hazırlanıyorsanız, NDA başvuru sürecinin nasıl işlediğini anlamanız gerekiyor. Ve bugün tam olarak buna odaklanacağız. Hadi başlayalım.
İlaç sektöründe NDA nedir?

NDA, resmi bir talep anlamına gelir. ilaç şirketi Yeni bir ilacın piyasaya sürülmesi için FDA'ya onay başvurusu yapılır. Bu, ilaç geliştirme sürecinin son adımıdır ve FDA'nın ilacın güvenli ve faydalı olup olmadığına karar vermesi için gereken her şeyi içerir.
Ancak süreç oldukça zahmetli. Bu yüzden sadece her 10 ilaçtan yaklaşık 1'i Klinik denemelere girenlerin ne kadarı onay aşamasına kadar ulaşabiliyor? Bu sayı, yolun zorluklarını ve NDA'nın oynadığı önemli rolü göstermektedir.
Gizlilik sözleşmesi (NDA) tam bir anlaşma gibi işlev görür. “"hikaye"” İlacın içeriği şöyledir:
- Tüm klinik araştırma sonuçları
- Güvenlik ve etkinlik hakkında eksiksiz veriler.
- İlacın nasıl üretildiğine dair detaylar
- Kalite kontrol ve stabilite bilgileri
- Ambalajlama, etiketleme ve önerilen kullanım talimatları
FDA, faydaların risklerden daha ağır bastığını doğrulamak için bu bilgileri inceler. Dahası, bu inceleme, üretim sürecinin sürekli olarak güvenli ve güvenilir bir ürün üretebildiğini kanıtlar.
İlaç Sektöründe NDA'nın Amacı
Yeni ilaç başvurusunun (NDA) temel amacı, yeni bir ilacın güvenli, etkili ve sürekli olarak yüksek kalitede üretildiğini göstermektir.
FDA, bu uygulamayı ürünün klinik verilerinden üretim sürecine kadar her parçasının katı standartları karşıladığını doğrulamak için kullanır. Bu gerekliliğin en büyük nedenlerinden biri de sorunları erken tespit etmektir.
NDA'nın (Yeni İlaç Başvuru Formu) amacı, hastaları tutarsız veya güvenli olmayan ürünlerden korumaktır. Bu form, FDA'ya ilacın nasıl üretildiğine ve güvenli olup olmadığına dair net bir bakış açısı sağlar. ilaç ekipmanı ve bunun ardındaki süreçler, her partide aynı kaliteyi sağlayabilir.
Gizlilik Sözleşmesinin Temel Bileşenleri
İlaç sektöründeki bir NDA (Yeni İlaç Başvurusu), FDA'ya bir ilacın nasıl performans gösterdiğine dair kapsamlı bir tablo sunan çeşitli önemli bölümler içerir. Bu gereksinimi karşılamak istiyorsanız bilmeniz gereken bileşenler şunlardır:.
1. Klinik Veri Paketi
Klinik veri paketi, Faz 1, 2 ve 3 çalışmalarından elde edilen tüm sonuçları içermektedir. Bu çalışmalar, ilacın insan vücudunda nasıl davrandığını, etkinliğini ve gerçek tedavi sırasında ortaya çıkabilecek potansiyel riskleri göstermektedir.
Bu bölümde ayrıca yeni formülasyon nedeniyle meydana gelen tüm olumsuz olaylara ilişkin güvenlik değerlendirmeleri ve ayrıntılı raporlar yer almaktadır.
2. CMC (Kimya, Üretim ve Kontroller)
CMC, bir NDA'nın en önemli kısımlarından biridir çünkü ilacın tam olarak nasıl üretildiğini açıklar. İlaç üretimiyle ilgili bilgileri kapsar. aktif farmasötik bileşen (API), Kalite standartları da dahil olmak üzere.
Dahası, bu bileşen, ham maddelerden nihai ürüne kadar üretim sürecini tanımlar. Bu bilgilerle FDA, ilacın büyük ölçeklerde tutarlı ve güvenli bir şekilde üretilip üretilemeyeceğini belirleyebilir.
3. Etiketleme ve Ambalajlama
Bu bölümde, önerilen ilaç etiketi ve ürünle birlikte verilecek tüm talimatlar özetlenmiştir. Bunlar arasında dozaj kılavuzları, kullanım talimatları, uyarılar ve güvenlik bilgileri yer almaktadır.
Açık etiketleme ve serileştirme Bu bilgiler hasta güvenliği için hayati önem taşır ve sağlık çalışanlarının ilacı nasıl uygulayacaklarını tam olarak bilmelerini garanti eder. FDA, içeriğin doğru olduğundan emin olmak için dikkatlice inceler.
4. İdari ve Yasal Gereklilikler
İlaç endüstrisindeki bir NDA'nın son bölümü, önemli yasal ve idari belgeleri kapsar. Bu aşamada, hasta sertifikaları, kullanıcı ücreti ödemelerinin kanıtı ve diğer gerekli düzenleyici belgeleri sağlamanız gerekmektedir.
Ayrıca, şirketin tüm FDA ve yasal yükümlülüklerini yerine getirdiğini teyit eden uyumluluk formlarını da içerir.
Gizlilik Sözleşmesi (NDA) Başvuru Süreci Nasıl İşliyor?
Yeni ilaç başvuru dosyası sunmak, FDA'nın eksiksiz, doğru ve yüksek kaliteli bilgi almasını garanti etmeye yardımcı olan yapılandırılmış bir süreçtir.
İşte mevzuata uygun olmak için izlemeniz gereken adımlar:
1. FDA ile NDA Öncesi Toplantı
Çoğu şirket, NDA başvurusu yapmadan önce bir ön NDA toplantısı düzenler. Bu toplantı, her iki tarafa da nihai klinik sonuçları, üretim verilerini ve kalan endişeleri gözden geçirme şansı verir.
Bu aynı zamanda FDA'nın başvuruda ne beklediğini netleştirmeye yardımcı olur ve bu da gelecekte gecikme riskini azaltır.
2. Eksiksiz Dokümantasyon Paketinin Hazırlanması
Plan onaylandıktan sonra şirket, klinik sonuçlar, CMC bilgileri, etiketleme taslakları ve idari formlar da dahil olmak üzere gerekli tüm verileri derler.
Bu adım, düzenleyici, üretim, kalite ve klinik ekipler arasında koordinasyon gerektirir. Her zaman hatırlayın, iyi organize edilmiş bir paket, sorunsuz bir inceleme şansını artırır.
3. FDA Elektronik Geçidi Aracılığıyla Başvuru
NDA başvurusu nihayet FDA'nın çevrimiçi sistemi aracılığıyla elektronik olarak gönderildi. ESG Yeni Nesil. Dosyanın FDA tarafından işlenip incelenebilmesi için katı biçimlendirme kurallarına uymasına dikkat edin. Başvuru gönderildikten sonra, FDA'nın dahili inceleme sürecine girer.
4. FDA'nın Detaylı İncelemesi
İnceleme dosyası sunulduktan sonra, FDA tüm verilerin ayrıntılı bir değerlendirmesine başlar. İnceleyiciler klinik performansı, üretim kalitesini, güvenlik bilgilerini ve etiketleme doğruluğunu değerlendirir.
Bu aşamada FDA sıklıkla sorular veya açıklama talepleri gönderir. Şirketler gecikmeleri önlemek için hızlı ve net bir şekilde yanıt vermelidir.
5. Nihai Karar ve Onay
Veriler güvenlik, etkinlik ve üretim tutarlılığını destekliyorsa, FDA onay mektubu yayınlar. Ancak, FDA önemli sorunlar tespit ederse, kurum bir ret kararı verebilir. Tam Yanıt Mektubu Düzeltilmesi gereken noktaları özetliyor.
Değişiklikleri yaptıktan ve onay aldıktan sonra, ürününüz artık ABD'de pazarlanabilir demektir.
NDA onay süreci ne kadar sürer?
Yeni ilaç başvurusunun onay süreci, ilacın aldığı değerlendirme türüne bağlıdır. Çoğu ürün için FDA, başvurunun kabul edilmesinden itibaren genellikle 10 ila 12 ay süren standart bir değerlendirme süreci izler.
Bazı durumlarda bir ilaç öncelikli incelemeye hak kazansa da, bu durumda onay süresi yaklaşık 6 aya kadar neredeyse yarı yarıya kısalır. Öncelikli inceleme yalnızca tedavide önemli iyileştirmeler sağlayan veya ciddi tıbbi ihtiyaçları karşılayan ilaçlara verilir.
SSS
1. Gizlilik sözleşmesi incelemesi sırasında tescilli veya gizli bilgiler nasıl korunur?
FDA, bir NDA'daki klinik ve CMC verilerinin büyük bir kısmını gizli ticari bilgi olarak değerlendirir. Kamuoyuna açık özetler ve onaylanmış etiketleme bilgileri yayınlanır, ancak ham veri kümeleri ve tescilli üretim detayları yasal gizlilik hükümleri kapsamında korunmaya devam eder.
2. Onaylanabilir mektup veya eksiksiz yanıt mektubu nedir?
FDA, sunulan belgeye onay veremezse, eksiklikleri ve gerekli eylemleri açıklayan eksiksiz bir yanıt mektubu yayınlar. Onaylanabilir mektup ise onaydan önce karşılanması gereken koşulları özetler. Sponsorlar, değişiklikler, yeni veriler veya risk yönetimi önerileriyle yanıt verirler.
3. Gizlilik sözleşmelerinde patentler ve münhasırlık ne zaman önem kazanır?
Sponsorlar patent bilgilerini sunar ve belirli süreler için jenerik ilaçların piyasaya girişini geciktiren düzenleyici münhasırlıklar talep edebilirler. NDA'daki patent listeleri, daha sonraki jenerik ilaç başvuruları için patent sertifikasyon süreçlerini de destekler. Münhasırlık türleri arasında yeni kimyasal madde münhasırlığı, pediatrik münhasırlık ve yetim ilaç münhasırlığı gibi türler yer almaktadır.
Yanlış Makinelerle Gizlilik Sözleşmenizin Elinizden Kaybolmasına İzin Vermeyin
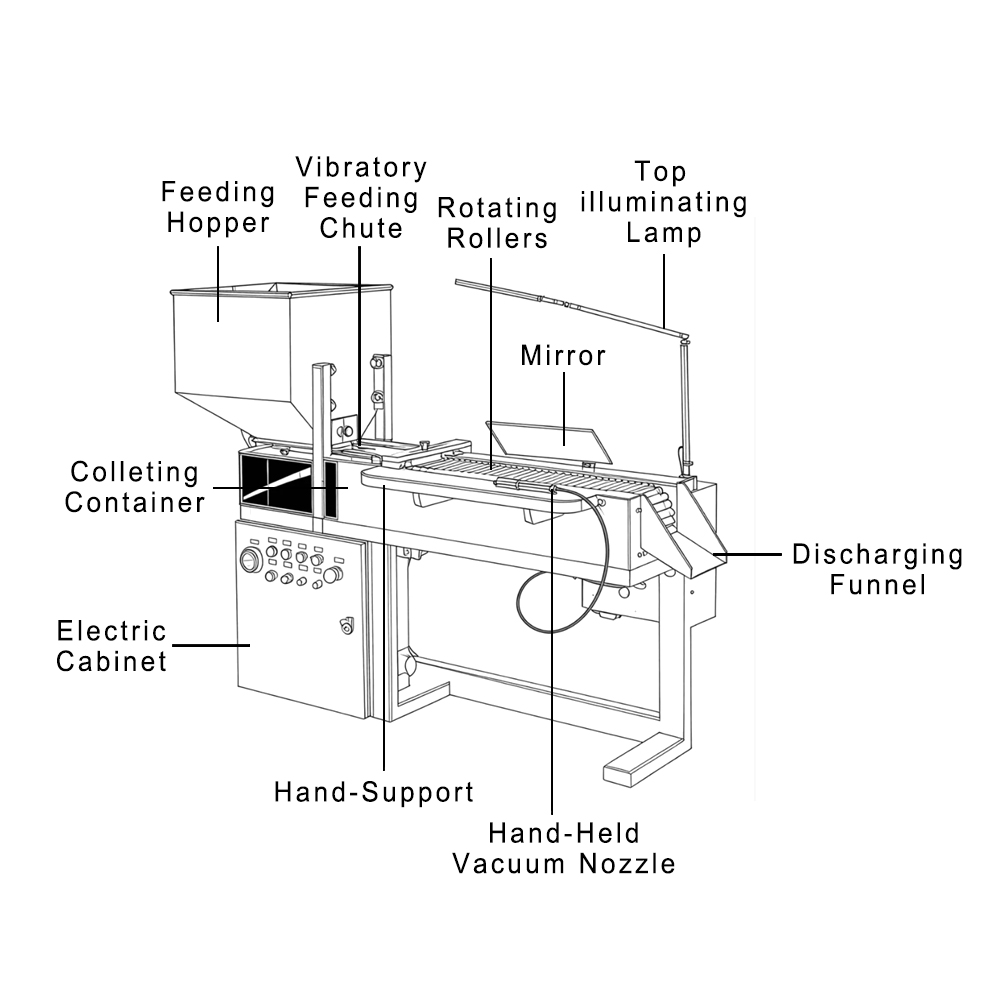
İlaç endüstrisinde NDA başvurusu yapmak önemli bir dönüm noktasıdır, ancak onay yalnızca klinik verilere bağlı değildir. FDA'nın en çok dikkate aldığı şeylerden biri de kullandığınız makinelerin kalitesidir. Bu da Finetech gibi güvenilir tedarikçilere sahip olmanın önemini göstermektedir.
İlaç üretim makinelerimiz, sürecin her aşamasında güvenilir ve uyumlu üretimi desteklemek üzere tasarlanmıştır. Aslında, 60'tan fazla ülkedeki üreticiler ve 500'den fazla müşteri, FDA onayı için gerekli teknik temeli güçlendiren ekipmanlar sağladığımız için Finetech'e güveniyor.
Makine arızası nedeniyle mahsur kaldıysanız, Uzmanlarımızla hızlı bir görüşme yapın. Bugün!