La etapa de NDA (Solicitud de Nuevo Medicamento) suele ser donde los equipos farmacéuticos sienten la mayor presión. Es el punto donde la FDA revisa formalmente años de desarrollo, pruebas e inversión.
En términos sencillos, una NDA en productos farmacéuticos es el documento que una empresa presenta a la FDA para solicitar la aprobación de un nuevo fármaco. Este es un hito importante en el desarrollo de cualquier medicamento.
Así que, si está desarrollando una nueva formulación o preparándose para escalar la producción, necesita comprender cómo funciona el proceso de presentación de la NDA. Y eso es precisamente en lo que nos centraremos hoy. Profundicemos en ello.
¿Qué es un NDA en productos farmacéuticos?

Un NDA es la solicitud oficial que un compañía farmacéutica Se presenta ante la FDA para obtener la aprobación para comercializar un nuevo medicamento. Es el paso final en el proceso de desarrollo de fármacos e incluye todo lo que la FDA necesita para decidir si el medicamento es seguro y eficaz.
Sin embargo, el proceso es bastante exigente. Por eso solo aproximadamente 1 de cada 10 drogas que entran en ensayos clínicos llegan a la aprobación. Esta cifra ilustra los desafíos del proceso y destaca el importante papel que desempeña la NDA.
Un NDA actúa como un acuerdo completo “"historia"” del medicamento. Contiene:
- Todos los resultados de ensayos clínicos
- Datos completos sobre seguridad y eficacia
- Detalles sobre cómo se elabora el medicamento
- Información sobre control de calidad y estabilidad
- Embalaje, etiquetado e instrucciones de uso propuestas
La FDA revisa esta información para confirmar que los beneficios superan cualquier riesgo. Además, demuestra que el proceso de fabricación puede producir consistentemente un producto seguro y confiable.
Propósito de un NDA en productos farmacéuticos
El propósito principal de una NDA es demostrar que un nuevo medicamento es seguro, eficaz y se fabrica consistentemente con alta calidad.
La FDA utiliza esta solicitud para confirmar que cada componente del producto, desde sus datos clínicos hasta su proceso de fabricación, cumple con estándares estrictos. Una de las principales razones de este requisito es la detección temprana de problemas.
Una NDA también existe para proteger a los pacientes de productos inconsistentes o inseguros. Proporciona a la FDA una visión clara de cómo se produce el medicamento y si... equipo farmacéutico y los procesos detrás de esto pueden ofrecer la misma calidad en cada lote.
Componentes clave de un NDA
Una NDA en productos farmacéuticos incluye varias secciones importantes que proporcionan a la FDA una visión completa del rendimiento de un medicamento. Estos son los componentes que debe conocer si desea cumplir con este requisito.
1. Paquete de datos clínicos
El paquete de datos clínicos incluye todos los resultados de los ensayos de fase 1, 2 y 3. Estos estudios demuestran el comportamiento del fármaco en el cuerpo humano, su eficacia y los posibles riesgos que pueden surgir durante el tratamiento.
Esta sección también contiene todas las evaluaciones de seguridad e informes detallados de cualquier evento adverso que ocurrió debido a la nueva formulación.
2. CMC (Química, Fabricación y Controles)
El CMC es una de las partes más importantes de un NDA porque explica exactamente cómo se fabrica el medicamento. Incluye información sobre... ingrediente farmacéutico activo (API), incluidos sus estándares de calidad.
Además, este componente describe el proceso de fabricación, desde las materias primas hasta el producto terminado. Con esta información, la FDA puede determinar si el medicamento puede producirse de forma consistente y segura a gran escala.
3. Etiquetado y embalaje
Esta sección describe la etiqueta propuesta del medicamento y todas las instrucciones que acompañarán al producto. Esto incluye pautas de dosificación, instrucciones de uso, advertencias e información de seguridad.
Etiquetado claro y publicación por entregas Son esenciales para la seguridad del paciente y garantizan que los profesionales de la salud sepan exactamente cómo administrar el medicamento. La FDA revisa cuidadosamente este contenido para garantizar su precisión.
4. Requisitos administrativos y legales
La parte final de un NDA en la industria farmacéutica abarca los documentos legales y administrativos clave. En este paso, se requieren certificaciones de pacientes, comprobantes de pago de cuotas de usuario y otros documentos regulatorios requeridos.
También incluye formularios de cumplimiento que confirman que la empresa cumple con todas las obligaciones legales y de la FDA.
¿Cómo funciona el proceso de presentación de NDA?
Presentar una NDA es un proceso estructurado que ayuda a garantizar que la FDA reciba información completa, precisa y de alta calidad.
Estos son los pasos que debes seguir para cumplir con la normativa:
1. Reunión previa a la NDA con la FDA
Antes de presentar una NDA, la mayoría de las empresas programan una reunión previa. Esta reunión brinda a ambas partes la oportunidad de revisar los resultados clínicos finales, los datos de fabricación y cualquier inquietud pendiente.
También ayuda a aclarar lo que la FDA espera en la solicitud, lo que eventualmente reduce el riesgo de demoras en el futuro.
2. Preparación del paquete de documentación completo
Una vez alineado el plan, la empresa recopila todos los datos necesarios, incluidos los resultados clínicos, la información de CMC, borradores de etiquetado y formularios administrativos.
Este paso requiere la coordinación entre los equipos regulatorio, de fabricación, de calidad y clínico. Recuerde siempre que un paquete bien organizado aumenta las probabilidades de una revisión sin contratiempos.
3. Envío a través del portal electrónico de la FDA
La NDA finalmente se envía electrónicamente a través del sistema en línea de la FDA llamado ESG NextGen. Asegúrese de que el archivo cumpla con las estrictas normas de formato para que la FDA pueda procesarlo y revisarlo. Una vez enviada, la solicitud ingresa al proceso de selección interno de la FDA.
4. Revisión exhaustiva de la FDA
Tras la presentación de la revisión, la FDA inicia una evaluación detallada de todos los datos. Los revisores evalúan el rendimiento clínico, la calidad de fabricación, la información de seguridad y la precisión del etiquetado.
Durante esta etapa, la FDA suele enviar preguntas o solicitudes de aclaración. Las empresas deben responder con rapidez y claridad para evitar retrasos.
5. Decisión final y aprobación
Si los datos respaldan la seguridad, la eficacia y la consistencia de la fabricación, la FDA emite una carta de aprobación. Sin embargo, si la FDA identifica problemas importantes, la agencia puede emitir una Carta de respuesta completa describiendo lo que necesita corregirse.
Una vez que realice los cambios y obtenga la aprobación, significa que su producto ahora puede comercializarse en los EE. UU.
¿Cuánto tiempo lleva el proceso de aprobación de NDA?
El plazo de aprobación de la NDA depende del tipo de revisión que reciba el medicamento. Para la mayoría de los productos, la FDA sigue una revisión estándar, que suele tardar entre 10 y 12 meses desde la aprobación de la solicitud.
Aunque en algunos casos un medicamento cumple los requisitos para una revisión prioritaria, si esto ocurre, el plazo de aprobación se reduce casi a la mitad, a unos seis meses. La revisión prioritaria solo se otorga a medicamentos que ofrecen mejoras significativas en el tratamiento o abordan necesidades médicas graves.
Preguntas frecuentes
1. ¿Cómo se protege la información confidencial o de propiedad durante la revisión del NDA?
La FDA trata gran parte de los datos clínicos y de CMC en una NDA como información comercial confidencial. Los resúmenes públicos y el etiquetado aprobado se publican, pero los conjuntos de datos sin procesar y los detalles de fabricación patentados permanecen protegidos por las disposiciones legales de confidencialidad.
2. ¿Qué es una carta de aprobación o carta de respuesta completa?
Si la FDA no puede otorgar la aprobación presentada, emite una carta de respuesta completa que describe las deficiencias y las medidas necesarias. Una carta de aprobación describe las condiciones que deben cumplirse antes de la aprobación. Los patrocinadores responden con enmiendas, nuevos datos o propuestas para la gestión de riesgos.
3. ¿Cuándo son importantes las patentes y la exclusividad en un NDA?
Los patrocinadores presentan información sobre patentes y pueden solicitar exclusividades regulatorias que retrasen la entrada de genéricos por períodos definidos. El listado de patentes en la NDA también facilita los procesos de certificación de patentes para solicitantes de genéricos posteriores. Los tipos de exclusividad incluyen la exclusividad para nuevas entidades químicas, la exclusividad pediátrica y la exclusividad para medicamentos huérfanos, entre otros.
No deje que su NDA se escape por una maquinaria inadecuada
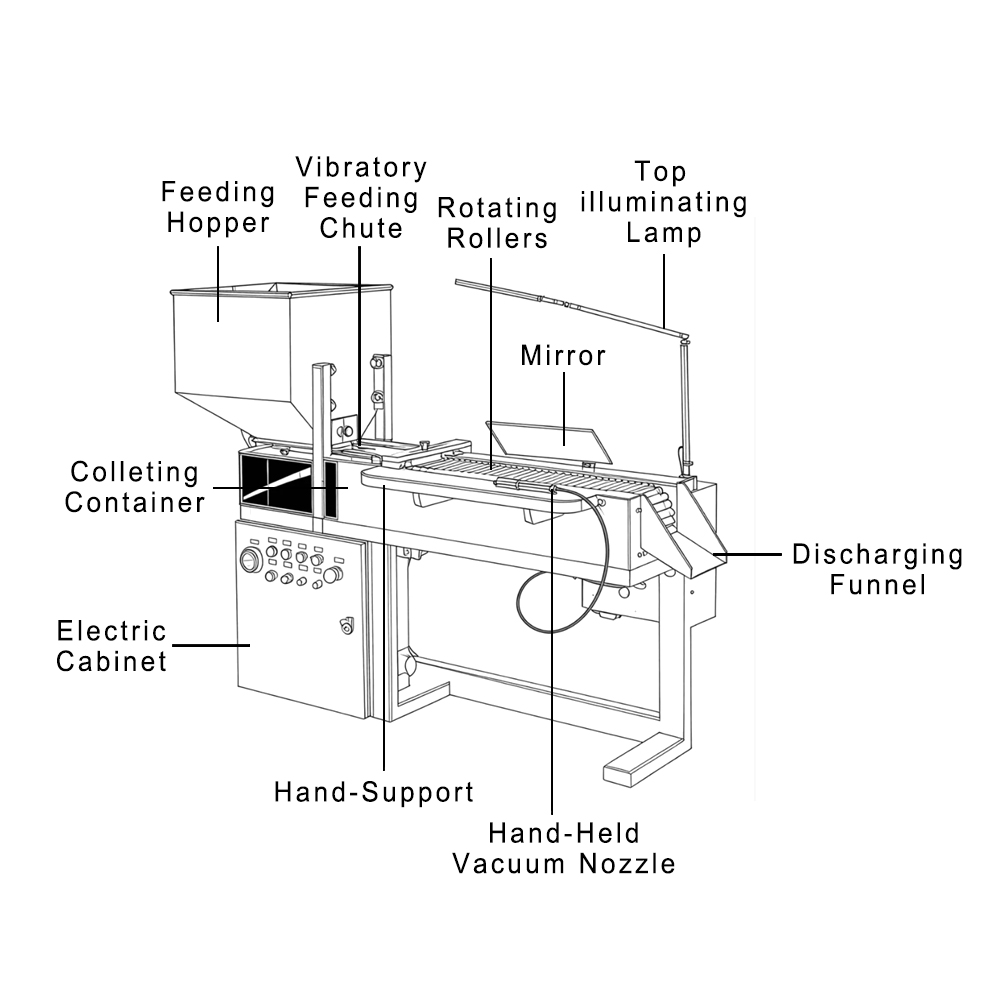
Presentar una NDA en la industria farmacéutica es un hito importante, pero la aprobación depende de algo más que los datos clínicos. Uno de los aspectos más importantes que la FDA examina es la calidad de la maquinaria que se utiliza. Esto demuestra la importancia de contar con proveedores confiables como Finetech.
Nuestra maquinaria farmacéutica está diseñada para garantizar una producción confiable y conforme a las normas en cada etapa del proceso. De hecho, fabricantes de más de 60 países y más de 500 clientes confían en Finetech porque ofrecemos equipos que refuerzan la base técnica necesaria para la aprobación de la FDA.
Si estás atrapado debido a la maquinaria, Concierte una llamada rápida con nuestros especialistas ¡hoy!